Inhalative Sedierung
Informativ und zielwertgesteuert
Vorteile der Sedierung mit volatilen Anästhetika
Schon seit vielen Jahren wurden immer wieder Versuche unternommen, die aus der Narkose bekannten Inhalationsanästhetika – Isofluran, Sevofluran, Desfluran – für die Sedierung beatmeter Patienten auf der Intensivstation zu nutzen. Denn volatile Anästhetika verfügen im Vergleich zu den bekannten intravenösen Sedativa über eine extrem kurze kontext-sensitive Halbwertszeit (Abb.) und damit eine exzellente Steuerbarkeit, weshalb sie für die kontinuierliche Sedierung geradezu prädestiniert sind.
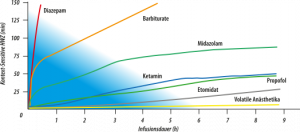
Kontextsensitive Halbwertzeit im Vergleich
Dabei ist ihre Metabolisierungsrate gering, aktive Metabolite werden nicht gebildet und es findet keine Enzyminduktion statt. Aus der jahrzehntelangen millionenfachen Anwendung in der Narkose ist die in klinischen Dosierungen praktisch fehlende Toxizität sowie die ausgezeichnete Sedierungsqualität in allen Sedierungsstufen bis zur tiefen Narkose bekannt.
Zahlreiche Untersuchungen belegen die Vorteile volatiler Anästhetika gegenüber Propofol und Midazolam hinsichtlich Aufwachzeiten, Vigilanz, Steuerbarkeit sowie Nebenwirkungen. So berichteten Meiser und Laubenthal über verkürzte Aufwachphasen, fehlende Atemdepression und geringere Beeinträchtigung der Darmmotilität mit der Möglichkeit eines früheren enteralen Kostaufbaus (Meiser und Laubenthal 2005). Mesnil und Mitarbeiter verzeichneten eine verbesserte Qualität des Aufwachens ohne Entzugserscheinungen nach Absetzen der Sedierung mit volatilen Anästhetika sowie einen verringerten Morphinkonsum nach Extubation (Mesnil et al. 2011, Sackey et al. 2005). Eine Kernaussage aller Arbeiten ist, dass die Extubationszeiten nach Sedierung mit allen volatilen Anästhetika signifikant niedriger sind als nach Midazolam und/oder Propofol. Ähnliches gilt für den Zeitraum bis zum Befolgen verbaler Aufforderungen.
Da es bei auch langdauernder Verwendung von volatilen Anästhetika weder zu Toleranzentwicklung noch zu Ceiling-Effekten kommt, Interaktionen mit anderen Medikamenten nicht bekannt sind und es zudem nach Beendigung der Anwendung seltener zum Auftreten von Entzugsdeliren kommen soll, sind volatile Anästhetika fast ideale Sedativa.
Ein entscheidender Vorteil gegenüber der Verwendung von intravenösen Substanzen besteht in der Möglichkeit einer kontinuierlichen Abschätzung der aktuellen Sedierungstiefe. Während die Sedierungstiefe bei Verwendung intravenöser Sedativa durch Messung von EEG-Surrogaten über Stirn-Klebeelektroden technisch schwierig und fehlerbehaftet ist (s.o.), erlaubt die kontinuierliche Messung der Narkosemittelkonzentration in der Ausatemluft des Patienten eine genaue, einfache und korrekte Aussage zur aktuellen Sedierungstiefe (Avidan et al. 2008, Kreuer et al. 2007, Servin und Billard 2014). Diese Möglichkeit wird während der Narkose schon seit Jahrzehnten genutzt und bedarf lediglich eines Monitors zur kontinuierlichen Messung der sog. endtidalen Narkosemittelkonzentration. Diese entspricht der Narkosemittelkonzentration in den Alveolen und somit annähernd der Konzentration im arteriellen Blut des Patienten (Eger et al. 1965, Michael 2006).
Neben kurzen Aufwachphasen (Jung et al. 2008, Sackey et al. 2004) und kurzen Zeiträumen bis zur Extubation (Hanafy et al. 2005) sind die kardioprotektiven Wirkungen volatiler Anästhetika schon seit Jahren bekannt (Kehl et al. 2004, Schlack et al. 2006) Die koronare Bypass-Operation und die Rekanalisierung nach akutem Myokardinfarkt sind typische Bespiele für Hypoxie und Reoxygenierung. Volatile Anästhetika sollen hier durch Prä- und Postkonditionierung deutliche Vorteile bieten. In einer italienischen Studie waren volatile Anästhetika bei Bypass-Operationen mit signifikant niedrigeren Troponin-Spiegeln assoziiert als unter intravenöser Sedierung (Guarracino F et al. J Cardiothor Vasc Anesth 2006; 20: 477-483), wobei die hämodynamische Stabilität der Patienten besser war (geringerer Inotropikabedarf ). Postoperativ war die Liegedauer im Vergleich zu den intravenös sedierten Patienten kürzer, insbesondere mussten weniger Patienten länger als 7 Tage stationär versorgt werden.
Eine Schweizer Studie untersuchte die postoperative Anwendung volatiler Anästhetika (Steurer MP et a. Crit Care 2012: 16: R191). Die Patienten erhielten eine intravenöse Narkose und wurden während des Weanings auf der Intensivstation (4-6 Stunden) volatil oder intravenös sediert. Auch diese späte Postkonditionierung lange nach der Reoxygenierung führte zu signifikant niedrigeren kardialen Bio-Markern.
Guerrero Orriach et al. kombinierten Sevofluran und Propofol in drei Gruppen (Sevofluran intra- und postoperativ, Sevofluran intra- und Propofol postoperativ, Propofol intra- und postoperativ) (Guerrero Orriach JL et al. J Crit Care 2013; 28: 879.e13-879.e18). Patienten, die nur Sevofluran erhielten, hatten signifikant niedrigere Troponin-Werte als die Patienten der beiden anderen Gruppen. Auch der linksventrikuläre Funktionsmarker NT- proBNP war mit Sevofluran nach 24 und 48 Stunden niedriger.
Ein großer retrospektiver Vergleich aus Skandinavien mit über 10.000 Patienten zeigte mit Sevofluran und Propofol eine vergleichbare 30-Tage Mortalität und Myokardinfarkt-Inzidenz (Jakobsen CJ et al. J Cardiothor Vasc Anesth 2007; 21: 664-671). Sevofluran-Patienten hatten jedoch häufiger Kammerflimmern, Propofol-Patienten dagegen häufiger Arrhythmien anderer Genese. In einer spanischen Studie mit 37 Propofol- versus 36 Sevofluran-Patienten (intra- und postoperativ) gab es keine Unterschiede hinsichtlich der kardialen Biomarker und des Inotropikabedarfs (Soro M et al. Eur J Anaesth 2012; 29: 561-569). Auf der Basis dieser Studien gibt es inzwischen explizite Empfehlungen in den Leitlinien: „Die Verwendung volatiler Anästhetika kann vorteilhaft sein bei hämodynamisch stabilen und kardial gefährdeten Patienten“ (Evidenzgrad B Klasse IIa) (Fleisher LA et al. Circulation 2007; 166: 1971-1996).
